来源:“药融圈”微信公众号 作者: 发表时间:2019-01-05 浏览:9781

方君平,来自美国加州的分享
我在美国仿制药行业至今有26年经验。我的经验基本上从仿制药前期一些项目研发到后来项目选项跟管理,包括公司的运营,基本上就是我的职业生涯。我在制药版块尽管做了26年,但是本身不是学药出身的。
我认为仿制药实际上跟做新药是两个不同的产业,仿制药其实是做一个me too product。只不过就是这个me too product你必须跟它做的一模一样,不能比它差,当然也不能比它好(BE等效,TE等效)。很早之前我回到国内时候,经常会有国内的同仁跟我提到他们做的产品比原研Branded还要好。
我从92年一直到94年,实际上是在作为一个formulation scientist 同时又是兼做process engineer,因为当时我参加的那个公司叫IVAX(爱华克斯)。如果是在仿制药界呆的比较久的可能会比较清楚,他是第一个仿制药公司业绩达到10亿美金的。之后变成Par子公司,再后来被仿制药巨头Teva收购。
离开这公司之后,来到加州创业,当时有几个台湾制药公司希望能够进入美国市场。在西海岸设立几个公司,其中有一个就是Stason。以上为我的个人履历情况。
实际上,当时在那个美国的制药界。有两个权威性的人物,一个就是Charlie Hsiao(萧俊雄),他已经过世了,Impax公司创始人之一,是我在Ivax时候的导师(mentor)。另外一个就是陈志明博士,Andrx。也是陈志明博士领我进入仿制药界的。
(药融科普:当时旅美华人制药界四大天王,华生(Watson)创办人赵宇天、Andrx创办人陈志明,Ivax创办人许照惠,Impax创办人许中强)
趁这个机会跟大家探讨一下,其实国内要做ANDA时间实际是蛮早的。我记得当时最早,把台湾公司放进去的话,在1993年-1934年就开始做这方面的工作。
第一家公司正式被FDA查厂的应该是生达制药,当时在2000年。当时是我们在1998年把一个产品转移到生达制药然后通过FDA的查厂。我还记得那是我第一次在美国之外,主导一家制药公司通过FDA审查。准备检查花了一年半的时间,包括帮助生达建立整个质量系统,当时台湾没有像样的GMP 系统。难点在于当时两百多个产品在市场上销售,不可能全部停产来整改GMP ,当时经过很多调整,最终是FDA 检查一次过,而且是0-483 。
Ivax出了一大批很好的管理人才,陈志明、萧俊雄都来自于这家公司。陈志明博士当时在2003年-2004年要再创业的时候,和Andrx有一个协议,不能进行仿制药上的工作,当时委托Stason做了一些项目,当然这都是过去的事情了。
实际上,我当时进入仿制药行业就是陈志明博士引领的。陈志明博士非常有趣的一点,当时招我进去的根本点在于我以前不是制药界的。仿制药其实很多的前期研发工作都被做完了,如何在放大生产中把仿制药做成工业化,做精做细,等效这很重要。我当时因为搞高分子材料,华东理工大学在化学方面还是比较强的,我们两个人一拍即合。
所以我刚才的问题就是说,国内现在仿制药的研发生产,有多少是从化学工程,或者是做材料工程的人员,进入到我们制药行业。其实我们当时在 Ivax 的时候有很多的第一,第一个在formulation group 里面全部用USP-III进行配方筛选,而不是用USP-I、II。因为我们发现USP-I、II在IVIVC的coordination上非常差。
其实学工程的人,有一个principle。你不需要问我是否有条件做出来,你只需要告诉我目的,我必须想办法把它做出来。
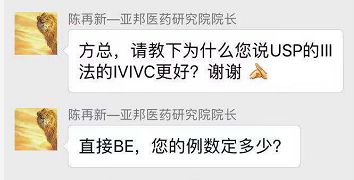
Q:亚邦医药研究院院长陈再新:方总,请教下为什么您说USP的III法的IVI?
A:这个上面请教过 USP的III的制定的几个专家,当时无非就是说在GI Track挪动上面,比 I /II更接近。而 USP的I/II ,它实际上有上百年的历史,无非就是当时是想要用标准化的方法来衡量不同产品的可比性。
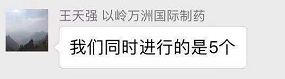
Q :以岭万洲国际制药王天强:能否问一下国内制剂产品同时上几个产品,按每年算?我们同时进行的是五个
A:同时进行五个是完全可能的,这也要看对产品而言,现在选品种标准是什么标准,为什么选择五个产品。在选产品上面国内选产品标准,为什么选择选这些产品,跟治疗领域、市场有关系,还是跟制剂能力,生产能力有关系,当然有一个最大的问题就是说API供应 。国内API 跟制剂配套程度是多少?API是会成为大家考虑的方向吗?但是制剂产业实际上跟API 的配套是非常关键。制剂因为它的整个工艺路线,所以它的成本是可以估计的出的,只要工艺流程定好,基本上就可以定好,但是如果要做一个成功的产品,没有API 的支持是绝对不行的。
我们之所以当时在上海建了泰亨这么一个研发平台,一开始就是为了当时在Ivax 大部分的API 都是从欧洲进的。当时会提供一些样品来做小试,问题是我们在做小试的时候他们也在做小试,我们在做中试的时候他们也在做中试,记住API 项目投资成本比制剂要高的多,一般API 厂家都不愿意提前放量,等放大之后,晶型、杂质可能有所变化,搞的我们的制剂非常被动,有时候不得不过去做的研发资料重新在做一遍。这时我们就在上海搞泰亨这样一个研发中心。
Q :以岭万洲国际制药王天强:美国ANDA,您是选择代理销售,还是自营销售?
A:我们基本上不会去做自营销售,如果你有足够的资金作为支撑,前几年做好了亏钱的准备,自营销售还是有它的好处的。但是一般讲起来,代理销售在前期是一个必选项目,这里牵扯到很多财务上面的事情,就比如说你需要大量资金压在里面。作为厂家基本上跟中间商之间45天之内就可以收到款。而销售商是卖给终端,这个钱需要汇回来,有可能需要一两年的时间,这个资金量是非常大的。
Q :以岭万洲国际制药王天强:在选择产品的时候,从历史上讲,主要仿制药企业,最开始先选10亿美元以上的,之后5亿、2亿,现在2000万美元。市场空间越来越小,对此您怎么看?
A:这个我是这么认为的,历史上仿制药最开始选10亿美元以上,92年的时候进入制药界美国当时仿制药200家都不到,现在的话全球实际上是非常多的,之前是做的人少,产品多所有可以挑挑拣拣,现在的问题是做的人多产品少。关键是看盈利额,而不是看市场份额,有些大产品为什么现在很少有人做,说到底就是不赚钱,往往盈利额在10个百分点左右,除掉销售链当中的一些费用,真正到手5个百分点都不到。上项目跟做房地产一样,只有买进就是投资进去的时候,你省钱了,你就是赚了,所有如果产品选好的话,几乎可以保证你不会亏钱,当然赚钱是另外一个事情,不会亏钱的保证就是前期投资成本一定要得到控制。这也就是说美国的仿制药公司很少有投1200万美金去投一个项目的。
Q :邓鹿江 海滨制药 研发VP:孤儿药仿制药您怎么看?
A:孤儿药仿制药我认为可以上,除非你是垂直整合,孤儿药现在做的人也不少,这个讲起来因为它的量不多,所有API 往往也非常难找,像这类药如果你能够找到还是可以去做做看。
Q :以岭万洲国际制药王天强:不知道您是否做过ANDA中美双报的项目(雷总孟鲁斯特成功了,华海也很多),由于ANDA美国市场不挣钱,转到国内申报,有什么需要注意的点呢?或者说将要遇到的难点。中美市场不同,中国仿制药价格普遍高于美国。
A:实际上我们作为中美双报的项目,中国市场是非常好的,这就是2017年我选择到中国来发展,主要有两个原因,一个是中美双报是不是有这个可能。经过一年的观察,中国产品的选项跟美国产品的选项往往是相反的,美国认为好的项目,中国不认为好,中国认为好的项目,美国不一定会觉得是好的产品。这就是为什么说中美双报做机会主义者,反正都开发这个项目就两边报。我们在帮国内做一致性评价也发现说他对CMC 要求上要多的多,那么也就是说,你这个产品选的时候,你是准备上中国的,还是准备上美国的,如果就是本来想准备先上美国市场的 ,返过来你要上中国市场的话,研发成本要增加的这块要算在中国的投入里面。相反的本来就是主打中国市场,如果同时报美国市场,它的研发成本几乎可以忽略不计,唯一可能会叫你补做BE。
Q :以岭万洲国际制药王天强:一些企业购买ANDA,然后生产工厂转移到国内,利用共线生产,在国内申报新药。在未来申报的时候,中国CFDA会不会要求重新做BE?因为毕竟原ANDA用于做BE的批次是原来的工厂生产的。
A:这个很多人都在问这个问题,我的建议是你在一开始做的时候准备要免BE的,你这个项目是没办法进行下去的,你永远不知道这个项目到底要不要做BE的。理论上是不需要做BE,但是往往你转移购买ANDA的产品,它本身在这个国家,比如说在美国GMP 1996年之前是一个标准2006年之前又是一个标准。而且你从商业谈判的角度来讲,如果没有预算一般国外的公司不愿意把ANDA转让给你的,所有我就说你在做和准备上这个项目的时候把这个预算放进去。当然你永远可以跟CFDA 提这个要求,当然允许你做当然是可以,不允许你做的话最起码你有预算可以把项目推动过去。
Q :王峰:在美国做BE预算资金需求多少?
A:BE预算资金要看产品,我目前做的最便宜的BE,大约是20万美金可以搞定。最贵大概是在70-80万美金。